生物学基础
外侧缰核在生理及病理条件下的环路和功能
2023-05-31 14:34:24
来自:brainnews创作团队
作者:胡海岚
阅读量:1
外侧缰核(lateral habenula, LHb)是大脑的“反奖赏中心”,它接收来自边缘前脑和基底神经节的输入,并主要靶向中脑单胺能神经调控系统。LHb独特的解剖学位置使其成为一个整合多种信息(包括基于价值、感觉和经验依赖性的信息)的中枢,以调节各种动机、认知和运动过程。
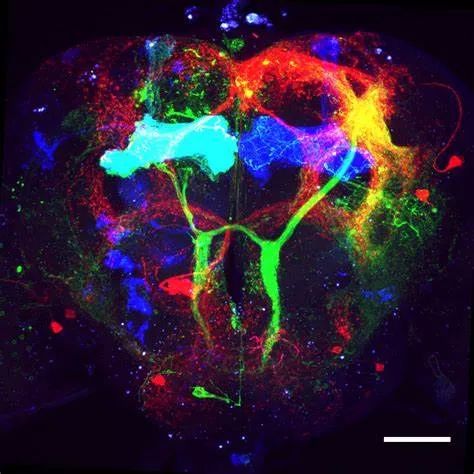
哺乳动物MHb和LHb亚区的基因表达谱和传入传出连接的模式明显不同。MHb中的神经元主要以乙酰胆碱、P物质和谷氨酸为神经递质,主要接收来自隔核(septum)的输入,并主要投射到脚间核(interpeduncular nucleus)。而LHb中大多数神经元是谷氨酸能的,主要接收来自基底神经节和边缘前脑的传入信息,并主要投射到前中部被盖核(RMTg)和中脑单胺能核团(图1)。
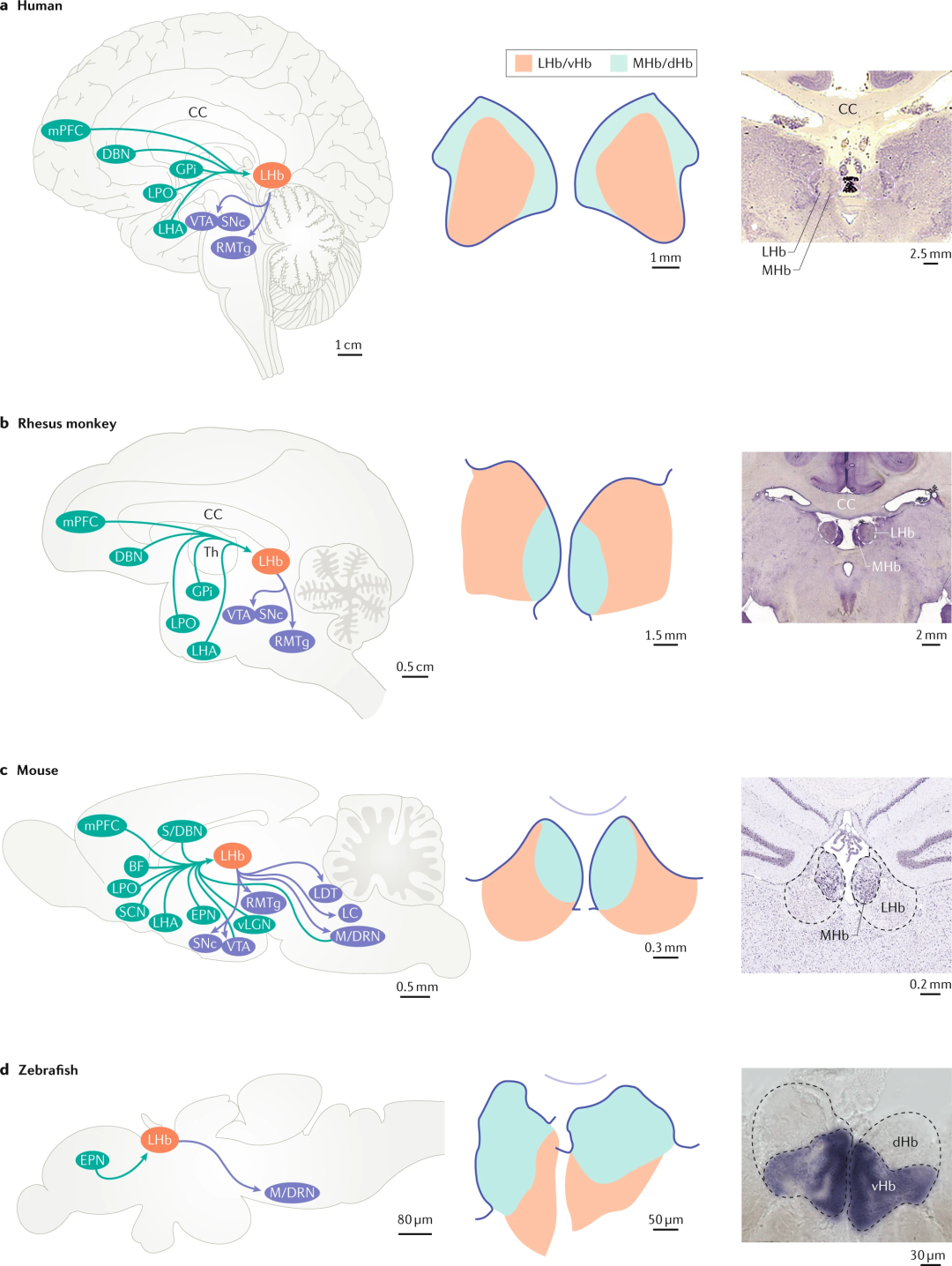
脊椎动物外侧缰核通路的进化保守性及缰核的解剖结构:最左列为不同物种外侧缰核(LHb)的同源环路(矢状位),LHb的输入核团为绿色,LHb的输出核团为蓝色。中间和最右列分别为不同物种缰核的冠状位示意图和组织切片。
外侧缰核LHb是连接边缘前脑和中脑单胺能核团的关键节点,也是少数几个既能支配多巴胺能系统,又能支配5 -羟色胺能系统的脑区之一,其战略定位是整合大脑的动机、运动和记忆系统。LHb调节各种基本的生理功能,本文特别关注其在奖赏和厌恶相关行为中的关键作用。
过去几年越来越多的文献表明,“反奖赏中心”LHb的功能障碍,可能参与了多种与奖赏环路失调相关的精神疾病,包括情绪障碍、精神分裂症和物质使用障碍等。其中,LHb与重度抑郁症的关系尤为密切。
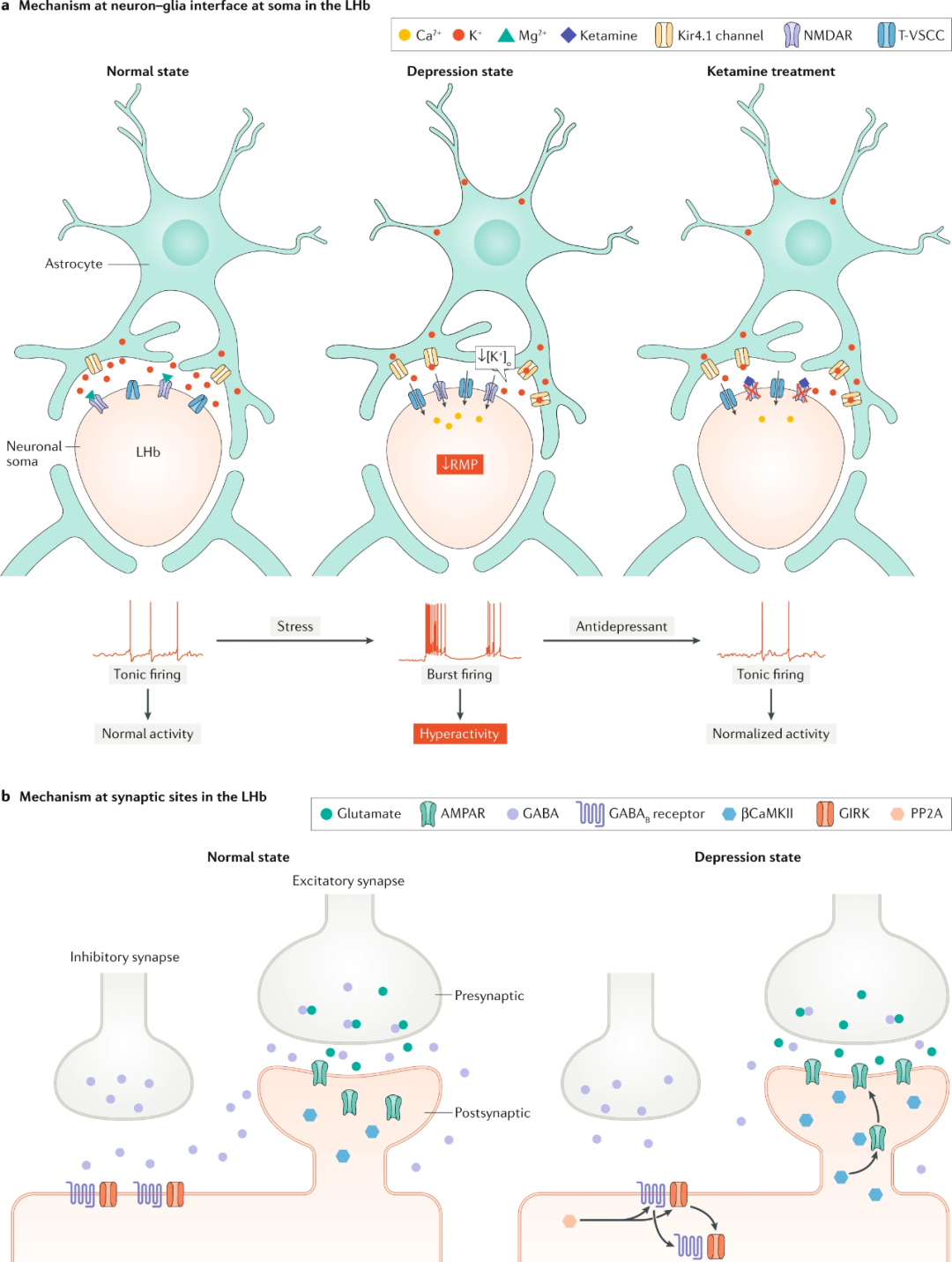
抑郁模型中LHb高度活跃的分子、细胞机制
2.物质使用障碍
在药物戒断的过程中,人们存在一种想要寻求药物的冲动,这种负面的动机状态就是“成瘾”。药物戒断状态是重度抑郁症经常出现的症状,如烦躁不安、快感缺失和对压力敏感性增强等。研究发现,LHb参与了各种物质使用障碍,尤其是在药物戒断的状态下。例如,LHb在可卡因戒断期间过度活跃,进一步证明了LHb过度活跃介导了一种负性情绪状态。
细致地研究外侧缰核在奖赏、厌恶、压力及认知过程中的作用,为LHb功能障碍如何影响情绪和物质使用相关障碍提供了新的见解。近期在鼠模型上发现,LHb是快速起效的抗抑郁药氯胺酮的主要作用靶点。这使LHb引起了更多研究者的关注,作者期待未来从分子、细胞和环路层面对LHb进行更为深入的研究。
1.LHb和其他调节负面情绪状态的脑区(如杏仁核)之间存在怎样的关系?
Hu H, Cui Y, Yang Y. Circuits and functions of the lateral habenula in health and in disease. Nat Rev Neurosci. 2020 Apr 8. doi: 10.1038/s41583-020-0292-4.
过去十年,越来越多的研究开始关注LHb在负向的动机行为以及重度抑郁中的作用。而近期,在药物戒断和重度抑郁的动物模型中,关于研究LHb引起负性情绪状态的分子和细胞机制的工作取得了令人兴奋的进展,未来的挑战就是将其转化为有效的临床治疗。

缰核是一种存在于几乎所有脊椎动物大脑中保守而古老的结构。在哺乳动物中,缰核位于丘脑后部上方靠近中线的位置,可分为内侧缰核(MHb)和外侧缰核(LHb)两个区域。在鱼类和两栖动物中,哺乳动物的MHb和LHb分别对应于其背侧缰核(dHb)和腹侧缰核(vHb)。
LHb越来越受到广泛关注的主要原因有三:LHb是少数几个既能调控多巴胺能系统,又能调控5 -羟色胺能系统的脑区之一。
Hikosaka及其同事开创性的研究揭示了LHb在编码负向奖赏方面的关键作用,特别是负向奖赏预测误差(Reward Prediction Error, RPE:预期奖励与实际奖励之间的差异)。
大量来自动物模型和人类的研究证据提示LHb与多种精神疾病,特别是重度抑郁症存在联系。在多种抑郁症动物模型中,缰核是唯一一个表现出活性持续增强的脑区。尽管人类的缰核体积很小,但近年来先进的技术使得研究者对这种结构的功能成像研究成为可能,并揭示了重度抑郁症患者缰核过度活跃的事实。此外,两项应用深部脑刺激(DBS)的临床试点案例表明,LHb功能失调至少与部分抑郁症的症状之间存在潜在的因果关系。最令人兴奋的是,对抑郁症动物模型的研究揭示了LHb关键的分子和细胞机制,并阐明了病因。氯胺酮是最有前途的快速抗抑郁药物之一,最近发现它可以抑制LHb神经元的簇状放电活动。这些发现可能为新一代抗抑郁药物的开发提供灵感。
本综述从以下三方面展开:外侧缰核LHb的基本结构:包括脑区分子标记物、电生理特性、解剖学亚区和环路连接。特别强调其上、下游通路及其具体功能。
LHb涉及的各种生理功能:强调其在编码负面奖赏信号和调控动机行为中的重要性。
LHb在精神疾病中的相关性:强调在抑郁症动物模型中导致LHb神经元异常活化的分子和细胞机制。
缰核的解剖结构
哺乳动物MHb和LHb亚区的基因表达谱和传入传出连接的模式明显不同。MHb中的神经元主要以乙酰胆碱、P物质和谷氨酸为神经递质,主要接收来自隔核(septum)的输入,并主要投射到脚间核(interpeduncular nucleus)。而LHb中大多数神经元是谷氨酸能的,主要接收来自基底神经节和边缘前脑的传入信息,并主要投射到前中部被盖核(RMTg)和中脑单胺能核团(图1)。

脊椎动物外侧缰核通路的进化保守性及缰核的解剖结构:最左列为不同物种外侧缰核(LHb)的同源环路(矢状位),LHb的输入核团为绿色,LHb的输出核团为蓝色。中间和最右列分别为不同物种缰核的冠状位示意图和组织切片。
1.分子标记物和亚区
外侧缰核LHb主要分为外侧缰核的内侧部分(LHbM)和外侧部分(LHbL)两部分,根据其解剖学位置,可进一步细分为7个亚核团(图2a)。
外侧缰核LHb主要分为外侧缰核的内侧部分(LHbM)和外侧部分(LHbL)两部分,根据其解剖学位置,可进一步细分为7个亚核团(图2a)。
LHb主要是谷氨酸能神经元,表达VGLUT2或VGLUT3的mRNA,但不表达VGLUT1。在功能上,这些谷氨酸能的LHb神经元对厌恶性刺激的反应是不均一的。研究发现,大多数对足底电击产生反应的LHb神经元是谷氨酸能的,其中78%被足底电击激活,而其余的则被足底电击抑制。
LHb是否存在GABA能神经元一直饱受争议。LHbM中有一小部分神经元表达GAD2(Glutamic Acid Decarboxylase 2)和GAT1(GABA Transporter 1),但它们是否表达VGAT(Vesicular GABA Transporter)存在争议,因此也并不清楚这群GABA能神经元能否正常发挥功能。
然而最近两项研究表明,光遗传学激活LHb中GAD2或PV(parvalbumin)阳性神经元可以局部抑制附近的细胞,这表明LHb中存在功能性的局部抑制环路。此外,各种单胺受体、神经肽和钙结合蛋白在LHb中也呈异质性分布。
LHb表达多巴胺D1类受体(Drd5)、D2类受体(Drd2)以及5 -羟色胺受体的mRNA,其中5 -羟色胺2c受体(Htr2c) mRNA在LHb中的表达更特异也更密集。在LHbM中,Drd2和Htr2c的表达似乎存在亚区互补;而在LHbL中,它们在部分亚区均有表达,这表明,LHbM和LHbL在单胺调节方面存在异质性。
而作为中间神经元marker的钙结合蛋白,calbindin和calretinin似乎选择性表达在LHbMPc和LHbMS亚区,而PV的表达则倾向于分布在LHbMC和LHbMPc。LHb中存在多种神经肽,并且都集中分布在LHb的内侧核心区。
有些marker在MHb和LHb中存在差异性表达,或者富集在这两个核团的边界处。例如CHAT(choline O-acetyltransferase)在MHb中表达量丰富,却不表达在LHb上,这与MHb在乙酰胆碱信号传递方面的突出功能一致。
Tac1(P物质相关)和Oprm1(阿片类受体MOR1相关)的mRNA富集并部分共定位在MHb和LHb之间的内侧边界亚区内,由于P物质和MOR1在疼痛与成瘾功能上存在相互作用,这种共定位模式显得十分有趣。此外,两个孤儿G蛋白偶联受体基因,Gpr139和Gpr151也富集在这两个核团的边界处,而脑内的Gpr151只在缰核表达。
神经系统基因表达图谱项目(GENSAT)的进展和近期一系列单细胞转录谱的研究为缰核的基因表达谱提供了更为全面的信息。这些研究利用特定细胞群中的基因差异性表达,为从基因和功能角度精准定位LHb及其亚区开辟了道路。
2.电生理特性
不考虑分子多样性,单从生理角度看,LHb的神经元在不同亚区是均匀的。与皮层或海马的锥体神经元相比,LHb神经元一般具有更高的输入阻抗和去极化更明显的静息膜电位(RMPs)。以SD大鼠为例,LHb神经元的静息膜电位为-60 ~ -40 mV,平均为-48 mV(图2b,c)。
不考虑分子多样性,单从生理角度看,LHb的神经元在不同亚区是均匀的。与皮层或海马的锥体神经元相比,LHb神经元一般具有更高的输入阻抗和去极化更明显的静息膜电位(RMPs)。以SD大鼠为例,LHb神经元的静息膜电位为-60 ~ -40 mV,平均为-48 mV(图2b,c)。
LHb的解剖分区、细胞和电生理特性离体脑片电生理记录显示,LHb除了无放电的沉默型神经元(silent neurons)外,还有两种自发放电模式:强直发放型(tonic firing type)和簇状放电型(bursting type)(图2b)。正常情况下,沉默型和强直型放电各占LHb神经元的40% ~ 50%,而簇状放电型神经元仅占SD大鼠LHb神经元总数的一小部分(小于10%)。
与其他两种神经元类型相比,簇状放电神经元的RMPs更为超极化(约-60 mV)(图2c,d)。然而,在响应膜超极化时,几乎所有LHb神经元都能转化为簇状放电神经元。这种电压依赖性是由低电压敏感的T型钙通道(T-VSCCs)介导的,该通道在低于-55 mV的短时超极化作用下被激活,并使钙离子内流引发簇状放电。
当T-VSCCs迅速失活时,NMDA型谷氨酸受体(NMDARs)驱动膜电位越过动作电位阈值来维持簇状发放。此外,LHb簇状放电还受胶质细胞特异性的钾离子通道Kir4.1的调控,Kir4.1通过调节细胞外钾离子水平来调节RMPs。
在功能上,LHb神经元的簇状放电特征在抑郁样行为以及动物模型中氯胺酮的快速抗抑郁反应中起到了关键作用。
3.LHb的输入、输出环路小结
输入:LHb主要通过髓纹纤维束(stria medullaris fibre tract),接收来自边缘前脑和基底神经节的传入信息,通过大量平行环路分别汇集到LHbM和LHbL。
输入:LHb主要通过髓纹纤维束(stria medullaris fibre tract),接收来自边缘前脑和基底神经节的传入信息,通过大量平行环路分别汇集到LHbM和LHbL。
科学家们已明确了十几条输入LHb的通路。而令人震惊的是,激活大部分这些输入投射会引起厌恶反应。那么LHb作为整合不同厌恶性输入的中枢,这种现象部分是由于光遗传学刺激产生的,还是反映了LHb的固有属性?
未来的研究应致力于明确特定的外部刺激,选择性地激活这些通路,以及激活每个通路时的生理发放模式(如发放频率,强直发放还是簇状放电)。我们迫切需要环路相关的内容指导未来光遗传学研究,旨在忠实地反映通路活动及其行为结果的联系。
输出:上游多样的信息在缰核内汇集后,通过后屈束(fasciculus retroflexus)向外投射向下游脑区。LHb输出的投射主要是兴奋性谷氨酸能投射,主要投射到GABA能的RMTg以及单胺能核团,包括多巴胺能和GABA能的VTA和黑质致密部(SNc),5 -羟色胺能的MRN、中缝背核(DRN)以及背外侧被盖核(LDT),肾上腺素能的蓝斑核(LC)以及导水管周围灰质(PAG)。
虽然外侧缰核可直接输出兴奋性投射到以上单胺能脑区,但大部分输出会通过RMTg这个抑制性脑区中转,因此,对下游核团折射出抑制效果。厌恶性刺激可以增加RMTg神经元活性,并激活LHb到RMTg的投射。在功能上,激活LHb-RMTg通路促进了主、被动和条件性回避行为,减少了努力行为,促进了由习得性无助范式诱导的抑郁样行为的发生。
尽管LHb对多巴胺能系统的调节已被广泛研究,但LHb如何调节其他单胺能系统,特别是5 -羟色胺能系统仍需进一步研究。
外侧缰核的生理功能
外侧缰核LHb是连接边缘前脑和中脑单胺能核团的关键节点,也是少数几个既能支配多巴胺能系统,又能支配5 -羟色胺能系统的脑区之一,其战略定位是整合大脑的动机、运动和记忆系统。LHb调节各种基本的生理功能,本文特别关注其在奖赏和厌恶相关行为中的关键作用。
1.奖赏行为
“趋利避害”的能力对动物的生存至关重要。当实际奖赏超过预期奖赏时,与奖赏相关的行为会被促进,通常被称为正向奖赏预测误差(positive RPE)。相反,当实际奖赏小于预期时,与奖赏相关的行为会被抑制,即负向奖赏预测误差(negative RPE)。因此,RPE是衡量预期奖赏和实际奖赏结果之间差异的一种方法,并作为一种强大的学习信号来指导趋避行为。
“趋利避害”的能力对动物的生存至关重要。当实际奖赏超过预期奖赏时,与奖赏相关的行为会被促进,通常被称为正向奖赏预测误差(positive RPE)。相反,当实际奖赏小于预期时,与奖赏相关的行为会被抑制,即负向奖赏预测误差(negative RPE)。因此,RPE是衡量预期奖赏和实际奖赏结果之间差异的一种方法,并作为一种强大的学习信号来指导趋避行为。
LHb神经元编码RPE与多巴胺能神经元的编码方向相反:当奖赏缺失或受到惩罚时(negative RPE),LHb神经元被激活;当意料之外的奖赏增加时(positive RPE),LHb神经元被抑制,这与LHb神经元抑制多巴胺能神经元的作用一致。
在恒河猴上的研究表明,LHb的负向RPE信号在到达多巴胺能神经元之前,被反转并传输到GABA能的RMTg或VTA和SNc的局部中间神经元,然后传出投向纹状体,以调节趋避行为(分别通过D1和D2受体)。
这些最初在猴子身上进行的观察,后来在人类功能成像的研究中得到了证实。以上研究表明,当缺乏预期的正向反馈或存在意料之外的负向反馈时,缰核的活性就会增强。此外,LHb神经元还可能有助于区分、量化不同奖励之间差异的复杂决策。
因此,LHb不仅可以负向调控VTA中多巴胺能神经元在处理奖赏相关信息和介导奖赏相关行为反应中的作用;还能通过与多巴胺能系统和5 -羟色胺能系统的连接,整合价值状态和价值变化的信息,成为调控以奖赏为基础的决策和情绪节点。
2.厌恶行为
LHb的一个主要功能是编码厌恶状态:首先,这和LHb在处理负面奖赏信息中的作用密切相关。小鼠和大鼠在面对各种压力源和负性情绪的刺激(如不可逃脱的足底或尾部电击等)时,可立即诱发LHb,特别是LHbM的神经元激活;电生理记录发现,LHb神经元的自发放电会因足底电击等负性刺激而增加。猴子的在体电生理记录也显示,预期奖赏的缺失和意料之外的惩罚信号都会强烈地激活LHb神经元。
LHb的一个主要功能是编码厌恶状态:首先,这和LHb在处理负面奖赏信息中的作用密切相关。小鼠和大鼠在面对各种压力源和负性情绪的刺激(如不可逃脱的足底或尾部电击等)时,可立即诱发LHb,特别是LHbM的神经元激活;电生理记录发现,LHb神经元的自发放电会因足底电击等负性刺激而增加。猴子的在体电生理记录也显示,预期奖赏的缺失和意料之外的惩罚信号都会强烈地激活LHb神经元。
其次,除了直接影响LHb神经元的活性外,压力应激还会改变LHb神经元的可塑性。压力极大地促进LHb中的LTP,并削弱内源性大麻素依赖的LTD。这种改变可能导致慢性应激下LHb活性的长时程变化,从而引起抑郁样行为。
多种动物模型的研究证实了LHb在编码压力和厌恶情绪中的作用,LHb活性与厌恶性状态之间存在因果关系。激活LHb产生抑郁焦虑样表型,而抑制LHb产生抗抑郁、抗焦虑效果。
3.小结
LHb不仅涉及奖赏和厌恶情绪的调节,还参与了运动抑制,工作记忆和长时程空间记忆,行为灵活性,睡眠和昼夜节律以及疼痛和镇痛等生理功能。
LHb不仅涉及奖赏和厌恶情绪的调节,还参与了运动抑制,工作记忆和长时程空间记忆,行为灵活性,睡眠和昼夜节律以及疼痛和镇痛等生理功能。
如此小的脑区涉及如此多样的生理功能实在令人震惊,但仔细想想也是合理的,因为这些生理功能中有许多是受单胺能系统调控的。
未来在这个脑区可能会发现更多受单胺能系统调控的生理功能。
1)LHb汇集上下游信息,影响多种行为,因此我们也能更好地理解为什么奖赏厌恶、学习记忆以及行为灵活性这些行为都是交织在一起的。
2)由于LHb存在多个亚区,不同功能可能是由不同亚区或通路所介导的。未来的研究目标是阐明具有特定分子特性或环路连接的LHb神经元能否专门介导不同的生理功能。
外侧缰核的病理生理学和功能障碍
过去几年越来越多的文献表明,“反奖赏中心”LHb的功能障碍,可能参与了多种与奖赏环路失调相关的精神疾病,包括情绪障碍、精神分裂症和物质使用障碍等。其中,LHb与重度抑郁症的关系尤为密切。
1.重度抑郁症
LHb与重度抑郁症的病理生理机制密切相关。图4基于不同物种的发现强调:LHb过度活跃在抑郁样行为的起因和表现中产生了保守且独特的作用。
LHb与重度抑郁症的病理生理机制密切相关。图4基于不同物种的发现强调:LHb过度活跃在抑郁样行为的起因和表现中产生了保守且独特的作用。
LHb是多种抑郁动物模型中唯一一致高度活跃的脑区下面,作者综述了抑郁样行为中,LHb高度活跃的潜在分子和细胞机制,尤其是LHb的簇状放电(图5a)。
1)LHb簇状放电在抑郁症和抗抑郁治疗中的机制
簇状放电型神经元在正常小鼠和大鼠的LHb中占很小一部分,但在啮齿类动物抑郁模型中,其比例翻了两三番。
簇状放电型神经元在正常小鼠和大鼠的LHb中占很小一部分,但在啮齿类动物抑郁模型中,其比例翻了两三番。
簇状放电可增强LHb对下游目标的的输出。因此,增强LHb的簇状放电可能对下游单胺能奖赏中心产生更强的抑制作用,从而导致抑郁。利用光遗传学特异性驱动LHb产生簇状放电,可诱导C57/B6小鼠的抑郁样行为(行为绝望和快感缺失),提示LHb的簇状放电与抑郁的诱导之间存在因果关系。
LHb神经元的簇状放电依赖于脑内NMDARs,而NMDARs正是快速起效的抗抑郁药——氯胺酮(ketamine)的主要分子靶点。研究发现,阻断LHb簇状放电是氯胺酮抗抑郁效果的基础。除NMDARs外,LHb神经元的簇状放电也依赖于T-VSCCs和神经元膜电位的超极化。
这些发现不仅为抑郁症的成因提供了新的分子、细胞和环路模型,还揭示了氯胺酮快速抗抑郁效果的潜在机制。
2)胶质细胞调控LHb神经元活动
作者近期在抑郁模型鼠上的工作证明:胶质细胞和神经元的相互作用在调节LHb神经元的RMPs和簇状放电方面起到了关键性作用。
作者近期在抑郁模型鼠上的工作证明:胶质细胞和神经元的相互作用在调节LHb神经元的RMPs和簇状放电方面起到了关键性作用。
蛋白质组学筛选发现,先天性习得无助大鼠(cLH)LHb中,胶质细胞上钾离子通道Kir4.1上调。Kir4.1存在于星形胶质细胞的突起中,它们紧密包绕LHb的神经元胞体。作者预测在这个相对封闭的胞外空间里,从活跃的神经元胞体释放出的钾离子会被Kir4.1清除。因此,Kir4.1上调可能导致细胞外钾离子水平降低以及神经元超极化。LHb的星形胶质细胞过表达Kir4.1,导致神经元超极化并增加簇状放电,进而诱发了小鼠抑郁样行为。反之亦然。
此外,LHb中星形胶质细胞功能失调还会干扰胶质细胞谷氨酸能的传递。因此,星形胶质细胞的钾离子通道Kir4.1双向调控LHb神经元的簇状放电和抑郁样行为。
3)抑郁症患者LHb的突触变化
通过多种机制协同发挥作用, LHb神经元突触前和突触后的突触特性被改变,输出增强,引起抑郁样行为。
通过多种机制协同发挥作用, LHb神经元突触前和突触后的突触特性被改变,输出增强,引起抑郁样行为。

抑郁模型中LHb高度活跃的分子、细胞机制
2.物质使用障碍
在药物戒断的过程中,人们存在一种想要寻求药物的冲动,这种负面的动机状态就是“成瘾”。药物戒断状态是重度抑郁症经常出现的症状,如烦躁不安、快感缺失和对压力敏感性增强等。研究发现,LHb参与了各种物质使用障碍,尤其是在药物戒断的状态下。例如,LHb在可卡因戒断期间过度活跃,进一步证明了LHb过度活跃介导了一种负性情绪状态。
其他种类的成瘾物质,如尼古丁、乙醇和阿片类物质等,也会引起LHb发放频率或兴奋性、抑制性突触传递的各种变化。对于LHb是否以及如何调节这些成瘾物质的各种影响,仍需要研究者从功能和行为上进一步探究。
3.精神分裂症
精神分裂症的多巴胺假说将其症状归因于大脑多巴胺能神经传递的增加。由于LHb和多巴胺能系统之间联系紧密,在精神分裂症的研究中会涉及LHb。精神分裂症患者在缰核表现出功能性连接的改变,并且对负向RPE的反应减弱。但由于缺乏可靠的精神分裂症研究范式,关于LHb在精神分裂症中的因果关系仍有待探究。
精神分裂症的多巴胺假说将其症状归因于大脑多巴胺能神经传递的增加。由于LHb和多巴胺能系统之间联系紧密,在精神分裂症的研究中会涉及LHb。精神分裂症患者在缰核表现出功能性连接的改变,并且对负向RPE的反应减弱。但由于缺乏可靠的精神分裂症研究范式,关于LHb在精神分裂症中的因果关系仍有待探究。
多巴胺假说主要解释了精神分裂症的阳性症状,而与另一谷氨酸能假说相关的NMDAR拮抗剂(苯环己啶、氯胺酮等)不仅可诱发阳性症状,还可诱发阴性症状和认知障碍。而NMDAR依赖的簇状放电是否参与精神分裂症,是在LHb还是其他脑区,也是尚待深入探究的问题。
结论与展望
细致地研究外侧缰核在奖赏、厌恶、压力及认知过程中的作用,为LHb功能障碍如何影响情绪和物质使用相关障碍提供了新的见解。近期在鼠模型上发现,LHb是快速起效的抗抑郁药氯胺酮的主要作用靶点。这使LHb引起了更多研究者的关注,作者期待未来从分子、细胞和环路层面对LHb进行更为深入的研究。
下面提出了一些在未来研究中值得思考的问题:
1.LHb和其他调节负面情绪状态的脑区(如杏仁核)之间存在怎样的关系?
2.LHb的亚区(LHbM与LHbL)是否存在特异性功能?
3.我们目前对LHb放电机制的理解如何转化为诊断和治疗抑郁症的临床应用?
参考文献:
Hu H, Cui Y, Yang Y. Circuits and functions of the lateral habenula in health and in disease. Nat Rev Neurosci. 2020 Apr 8. doi: 10.1038/s41583-020-0292-4.
[责任编辑]杜新忠
