丁丙诺啡
宽松的监管:对加拿大丁丙诺啡制剂监管历史的批判性审查
2022-07-05 11:49:30
来自:国际药物政策杂志
作者:Abhimanyu Sud,Meghan McGee
阅读量:1
药品监管的作用是保护公众免受不安全产品的侵害,这是加拿大卫生部支持人口健康使命的核心活动。然而,监管也对市场准入和药品价格产生影响。加拿大卫生部的监管角色位于莫兰所说的医疗保健国家的三个方面的交叉点:监管、工业发展和分配冲突的管理。本文将批判性地研究Suboxone的监管历史,这是一种用于治疗阿片类药物使用障碍的阿片类药物组合产品,以及称为Sublocade的新型长效丁丙诺啡制剂。我们建议将此作为“宽松监管”的案例,其中旨在通过保护市场排他性和促进私人利润产生来促进药物创新的议程损害了加拿大卫生部的监管职能,可能对药品定价和药品准入产生不利影响。
Suboxone在加拿大的监管历史既没有被充分记录,也没有经过严格审查。这样做是必要的,原因有两个:为应对阿片类药物的流行而为这种药物提供了自豪感,以及相关的有影响力的呼吁放松管制和更广泛的Suboxone处方和加拿大出现了两种新的丁丙诺啡品牌配方。在本文中,我们将研究Suboxone的加拿大历史,并说明与美国的相似之处,在美国,药品监管过程的违规行为或某些人认为的“滥用”已经有据可查。最后,我们将建议进行额外的分析,以进一步证实这些发现并确定可能的整改政策。
Suboxone最初进入并因阿片类药物使用障碍而声名鹊起
作为可溶性舌下片剂或薄膜的丁丙诺啡-纳洛酮Suoxone已成为加拿大阿片类药物使用障碍的一线治疗药物。随着阿片类药物相关危害的流行持续增长,Suboxone已被主要的联邦和省级文件引用为危机政策应对的关键部分。虽然被批准用于治疗阿片类药物使用障碍,但丁丙诺啡是一种阿片类药物,并且有充分记录的滥用历史。Suboxone与纳洛酮的联合配方旨在解决这个问题。作为一种强效的阿片类药物拮抗剂,如果将复合制剂药物注射或吸食而不是在舌下吸收,纳洛酮应该会阻断丁丙诺啡的作用。然而,在美国和加拿大获得批准时,没有充分的证据表明这种复合制剂能有效降低这种风险。近二十年后,这一假设越来越受到质疑。
ReckittBenckiser主要是一家家用消费品公司,在1997年将全球许可出售给先灵葆雅之前,最初拥有该配方的权利。随着利润丰厚的美国市场收入的增加,ReckittBenckiser在2010年之前回购了大部分权利,并最终在2014年创建了Indivior,作为以Suboxone为主要控股公司的以制药为重点的分拆公司。Suboxone及其相关制剂Subutex于2002年获准在美国上市,拥有整整七年的市场独占性,尽管这些药物的所有相关专利均已到期。ReckittBenckiser根据孤儿药法案获得了这些产品的市场独占权成本回收原则,尽管很少被授予那些表现出“没有合理期望”来收回开发和营销成本的制造商。尽管美国阿片类药物使用障碍的患病率很高且不断上升,而且开发成本已通过美国国立卫生研究院和国家药物滥用研究所获得公共资助。自1983年以来,基于成本回收,只有三种药物被授予孤儿药专营权,Suboxone和Subutex是其中的两种。仅2012年,Suboxone在美国就创造了15.5亿美元。
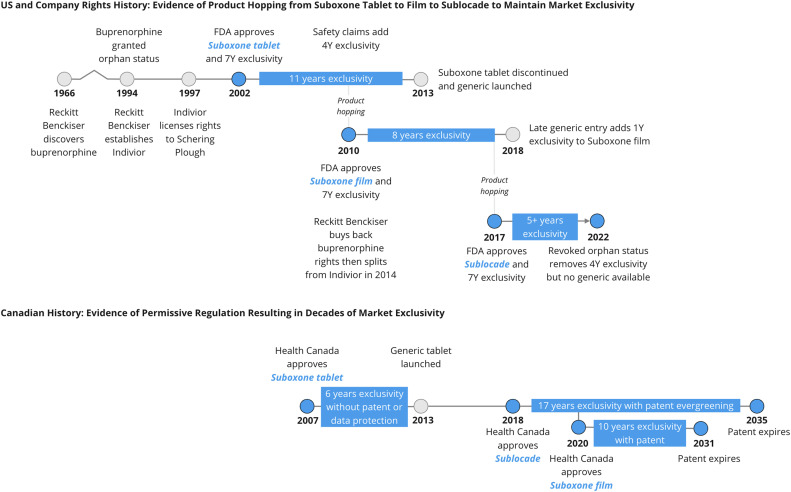
图1 Suboxone在美国和加拿大的监管历史
Suboxone在加拿大的市场独占性
Suboxone于2007年5月18日在加拿大获得批准,并在此后不久上市。Mylan的第一个仿制药版本于2013年7月4日获得批准,随后是Teva、ActavisPharma、Pharmascience和Taro。因此,Suboxone在加拿大拥有超过六年的独家经营权。与美国不同,Suboxone似乎在没有正式申请的情况下在加拿大获得了市场独占性,这引发了对药物监管、创新和准入的担忧。
在加拿大有两种排他性的法律途径。第一种是通过专利,制药商通常通过专利在加拿大申请专利后获得20年的独家经营权。该专利保护旨在通过为制造商提供一个收回开发成本的窗口来推动药物创新。然而,加拿大卫生部的专利登记处没有发现与丁丙诺啡-纳洛酮片剂相关的当前或过去专利。第二种获得市场独占权的途径可能与第一种重叠,是通过加拿大卫生部授予创新药物的数据保护。鉴于市场批准所需的临床试验可能会占用大部分专利期,因此该途径可防止仿制药生产商在六年内使用现有公司的临床数据,并在八年内阻止生物等效仿制药的上市。为了在这六年期间获得市场准入,制造商必须进行自己的临床试验。这通常被仿制药公司认为成本过高,即使他们可能会提交在加拿大境外进行的临床试验数据。同样,对加拿大卫生部创新药物注册的搜索显示没有为丁丙诺啡-纳洛酮片剂分配数据保护。与FDA的“橙皮书”概述了所有已批准药物的排他性津贴不同,加拿大卫生部除了专利登记册和创新药物登记册之外没有提供任何透明的清单,在这种情况下,它们没有提供对排他性机制的深入了解。
在没有专利或数据保护的情况下,由于缺乏仿制药竞争,Suboxone很可能实现了市场独占性。直到2013年美国首次获得仿制药批准后,没有仿制药制造商在加拿大申请监管批准。由于较小市场的盈利能力存在不确定性,行业有时会犹豫是否将药物提交给加拿大卫生部进行监管审查——Suboxone在加拿大的批准比美国晚了五年——尤其是由于各省之间的差异导致报销途径显得复杂时等人,2015年)。无论根本原因是什么,由于来自仿制药公司的竞争有限,加拿大药品的获得可能会延迟并且容易出现高定价。
Suboxone教育计划:降低风险还是提升风险?
在加拿大寻求批准的新阿片类药物提交必须包括风险管理计划。RMP描述了制造商为保持药物的安全使用而开展的一系列活动。作为RMP的一部分,制造商必须鼓励临床医生参与经认可的教育计划。然而,宽松监管的一个明显例子是Suboxone对其产品的品牌化、未经认可的“教育”计划。该计划在产品专论中进行了概述,该专论是加拿大卫生部批准的描述药物特性、使用条件和适应症的科学文件,旨在“没有宣传材料”
Suboxone教育计划是加拿大医药产品专着中极不寻常的内容,它通过在计划的标题中包含品牌名称来蔑视加拿大继续医学教育标准。几乎没有证据支持由制造商开发和提供的继续医学教育作为降低风险的有效干预措施。事实上,正如芬太尼所证明的那样,制造商赞助的另一种阿片类药物教育计划通常包含营销信息,宣传对该产品的更有利看法。Indivior似乎通过将教育计划命名为“SuboxoneCME”,进一步跨越了教育和推广之间的界限。
在美国,丁丙诺啡受到联邦监管,所有临床医生在开处方前都需要完成8小时的培训。但加拿大卫生部选择将处方监管委托给每个省,导致标准不一致。在许多省份,医生必须在开具丁丙诺啡处方前完成经批准的教育,其中Suboxone教育计划虽然未经认可,但是必需的计划或至少是几个经批准的计划之一。即使在这个治疗领域之外,监管、处方教育和促销之间的界限模糊也是一个普遍的问题。
由于医学教育不足,慢性疼痛和物质使用障碍的临床实践不佳。以医学教育为幌子的行业促销与阿片类镇痛药处方的兴起及其伴随的危害有关。此外,资助非行业教育计划一直是加拿大和美国政府应对阿片类药物危机的关键部分)。特别是在监管层面,美国制定了阿片类镇痛剂风险评估和缓解策略作为一项重要的联邦阿片类药物危机应对措施。这一广泛的REMS计划与加拿大卫生部的RMP相媲美,旨在通过建立与行业保持距离的资金池来限制行业影响力,以支持阿片类镇痛剂和慢性疼痛管理继续教育计划的开发和评估。然而,最近对REMS计划的评估表明,对行业披露指南的遵守不力和评估方法不佳,导致无法评估该计划对降低风险的影响。同样,该计划因选择有利于行业议程的内容而受到批评。
在对丁丙诺啡和美沙酮处方继续医学教育计划的系统评价中,我们发现只有一项研究检查了对转移和医疗外使用的影响。这项由ReckittBenckiser资助的研究仅检查了处方者知识和态度的变化,而不是处方者表现或患者健康结果的变化。总而言之,没有证据表明对患者健康有任何好处,而且对有利于行业的信息的担忧,支持了加拿大卫生部对Suboxone教育计划的监管要求加强了产品推广而不是风险最小化的论点。
重新制定和重新包装,但不进行品牌重塑——扩大Suboxone的市场排他性
2009年,Suboxone的“孤儿药”专营权将在美国到期。然而,ReckittBenckiser据称参与了“产品跳跃”,该计划旨在通过一种新的丁丙诺啡-纳洛酮配方来扩大市场排他性——也被称为Suboxone,但被重新配制为舌下薄膜而不是片剂。随着片剂的排他期即将结束,该公司向FDA声称,该片剂具有儿童过量服用的过度风险,因为片剂是在瓶中分多次分配的,而薄膜是单独包装的,对儿童来说更难不小心消费了多部电影。该公司还声称这部电影将解决平板电脑的转移风险,但证据尚无定论。在这种安全的幌子下,ReckittBenckiser将其舌下片剂从市场上撤下,使该薄膜成为唯一可用的配方。公设辩护人和仿制药制造商都对安全和转移风险的主张提出了质疑,他们最终胜出。但法律纠纷将丁丙诺啡-纳洛酮片剂的仿制药市场准入推迟到2013年——这使得ReckittBenckiser的整整四年销售额达到十亿美元。
到2018年,电影的市场独占性也成功地受到了印度迈兰和雷迪博士的挑战。Mylan与Indivior达成和解,但Dr.Reddy's继续成功推销这部电影并打入利润丰厚的美国市场。美国卫生与公众服务部部长亚历克斯?阿扎尔公开庆祝了仿制药的这一成功挑战,他强调了增加丁丙诺啡-纳洛酮获取的重要性)。他在声明中宣布:“[我们]很高兴FDA批准了一种药物辅助治疗方案的通用版本。这些批准将有助于增加竞争、降低成本并挽救生命,推进[HealthandHumanServices]的优先事项,以降低药品价格和对抗阿片类药物的流行。”
美国的这段历史与加拿大的监管高度相关。Suboxone电影于2020年7月在加拿大获得批准,在线Suboxone教育计划于2020年12月20日相应更新,这表明这将继续成为监管批准的重要组成部分。加拿大健康药物和技术机构,一个国家健康技术评估机构,审查了这部电影,发现与平板电脑相比没有安全优势。重要的是,片剂和薄膜共享一个产品专论,其中记录了两种配方的相同剂量和安全信息。因此,Suboxone薄膜在治疗上可与片剂互换,这表明创新存在问题。
提供市场排他性作为创新途径与确保公众获得负担得起的挽救生命的疗法之间存在利益冲突。就Suboxone薄膜而言,与片剂相比,在安全性、有效性或便利性方面没有明显的创新。专利本身并不能很好地代表健康创新。此外,美国的法院裁决认定制造商错误地试图延迟仿制药竞争,导致ReckittBenckiser被处以14亿美元的罚款,这是制药阿片类药物历史上最大的和解之一。美国司法部,2019年)。同样,对于更大的美国市场,薄膜配方的仿制药生产已经很活跃。鉴于关系重大的公共利益,加拿大卫生部有责任在其监管角色之外并与其他联邦机构合作,确定帮助采购额外供应的途径,从而降低成本。这可能包括诸如发展公共制造能力或促进强制许可等干预措施。自专利保护兴起以来,后者尤其具有用于促进公共利益的使用和接受历史。事实上,一些学者认为,强制许可不会实质性地阻碍创新)。
如果未能在联邦层面进行干预,那么省级药品报销计划可以通过拒绝支付品牌产品的全部成本来帮助降低成本。事实上,这就是阿片类镇痛药羟考酮的品牌配方所发生的情况,在加拿大被称为OxyContin和OxyNEO。当OxyContin的独占期即将到期时,PurduePharma将其从市场上撤下,并重新配制了与OxyNEO相同的药物并申请了专利)。这种重新配方以“防篡改”形式出现,旨在阻止注射或吸食药物。加拿大卫生部批准了OxyNEO,但大多数药物福利计划拒绝报销全部费用。在加拿大,没有“防篡改”的更便宜的通用制剂可用于治疗用途。
重新制定和品牌重塑
在Suboxone片剂的进一步发展中,Indivior还将注意力集中在Sublocade上,该药物每月注射一次。最初在美国,该配方旨在根据Hatch-Waxman数据保护立法拥有三年的市场独占权。然而,在一个非常不寻常的举动中,FDA根据1994年对Subutex的原始孤儿裁决授予Sublocade孤儿药地位。然而,在2020年,数据保护和孤儿药的独占权都被另一家公司成功地在法庭上提出质疑,导致Sublocade的美国市场独占权于2020年11月30日到期。FDA甚至撤销了Subutex1994年最初的孤儿药地位,称成本回收原则的使用是基于ReckittBenckiser的错误假设。
然而,加拿大有不同的故事。Sublocade于2018年11月获得批准,并受专利保护,该专利于2011年6月提交,因此直到2031年才到期。2019年6月授予了一项针对治疗适应症的小幅扩展的额外专利,并将于2035年到期,延长Sublocade的排他性延长了四年。这表明专利常青化的做法,一种延迟仿制药竞争的技术。与Suboxone类似,由制造商创建并由权威物质使用机构推荐的“Sublocade培训计划”。在对各种丁丙诺啡制剂的审查中,CADTH确定Sublocade在治疗阿片类药物使用障碍方面表现出与安慰剂相比的功效,但它没有确定与其他丁丙诺啡制剂或其他治疗方法的任何比较有效性试验。因此,CADTH建议将Sublocade用于公共处方集,但比建议的每月550加元的费用有73%的折扣。但是,每个省都可以选择是否遵循建议。安大略省是该国人口最多的省份,选择支付这种药物的全部费用,但价格未知。
这凸显了与Suboxone电影相同的困境,并确定加拿大卫生部需要公开澄清类似于FDA在橙皮书中发布的排他性状态。似乎Indivior对可注射丁丙诺啡具有市场独占权,并且至少一些公共保险公司愿意为该药物支付全部费用。因此,加拿大卫生部批准受专利保护的丁丙诺啡制剂的决定给省级公共保险公司带来了过度的负担,因此最终使加拿大人承担了为一项充其量是微不足道的“创新”支付费用的负担,而美国监管机构则认为这种“创新”不值得保护。在这种情况下,加拿大卫生部有机会通过实施鼓励或以其他方式促进低成本选择进入的政策来减少该国阿片类药物过量死亡。
进一步研究的领域
未来的研究可以通过分析其他数据源来深化这种分析。首先,截至2019年,加拿大卫生部已承诺发布匿名临床数据和其他监管提交材料,用于为药物批准和其他监管活动提供信息。这包括应要求追溯发布信息。访问与监管批准过程相关的文件,特别是加拿大卫生部对提交数据的解释,可能有助于了解Suboxone是否被授予市场独占权、理由是什么以及RMP的细节。这些可以通过访问信息请求来请求,但尚不清楚将发布哪些信息以及何时发布。
结论
制药公司强调创新和操纵药品监管的能力并非加拿大独有。美国和欧洲都报道了监管机构不遵守其技术标准而违背制造商利益的宽松监管。在开始记录加拿大Suboxone监管的历史时,我们发现了一些不一致的地方,这些不一致似乎有利于市场排他性和产品推广的特定创新议程,而不是保护公共安全的核心监管职能。这种“创新”观点与其他强调有效卫生技术可及性的观点相冲突。创新议程虽然对加拿大政府和更大的“医疗保健州”可能很重要,但并不是加拿大卫生部明确使命的核心)。事实上,加拿大卫生部已发布公告并采取其他举措来解决加拿大与阿片类药物相关的危害。该分析表明,加拿大卫生部的原则正在受到工业和经济发展目标的影响——由于被认为对遏制重大健康危机至关重要的药物成本过高,可能会损害公众健康。当市场排他性在提供有效和可及的卫生技术方面的价值本身受到审查时,这一点尤其重要。
重要的是,在对Suboxone薄膜和Sublocade重新配方进行监管处理的背景下,存在纠正创新与公共卫生相关目标之间不平衡的机会。加拿大卫生部可以实施三项具体政策来解决已确定的问题:首先,按照美国FDA的做法,公布所有批准药物的排他性状态;第二,落实保障措施,确保制冷剂管理计划为善意服务患者安全目的以及教育材料独立于制造商,而不是保护公司的市场优势;第三,制定衡量公共利益与专有权的标准,并制定一套纠正不平衡的政策选择。第一个政策可以立即实施,前提是有足够的资源来阐明监管机构对排他性的理由。第二个更为复杂,因为辨别安全性与市场优势是否是RMP的主要目的将涉及随着时间的推移跟踪RMP。一种提议的解决方案可能是建立与美国类似的流程,潜在的仿制药制造商可以通过单独的审查流程提交其REMS。同样,加拿大卫生部必须投入资源监测RMP,以确保它们不会成为仿制药进入的过度障碍。最后,第三项政策可以以临时实施的新强制许可机制为蓝本,以帮助应对COVID-19大流行。在这种机制下,卫生部长不必表现出诚意努力从专利持有人那里获得自愿许可,而是可以在加拿大首席公共卫生官认为存在“公共卫生紧急情况”的情况下启动许可申请。这是一个国家关注的问题。”持续的阿片类药物过量危机很容易达到这一阈值,甚至在首席公共卫生官关于加拿大公共卫生状况的报告中也确定了这一点。重新引入该机制所需的唯一更改是废除与该条款有关的2020年9月30日的到期日,从而实现对Suboxone和Sublocade配方的强制许可。
虽然可能需要对加拿大卫生部的做法进行其他改革和改变,以充分恢复监管机构的消费者保护作用,但这三项政策行动将有助于解决加拿大卫生部迄今为止对丁丙诺啡制剂处理不当所引发的具体问题。
[责任编辑]杜新忠
